Vero 細胞在 WAVE 反應器中的微載體球轉球放大
Vero 細胞在 WAVE 反應器中的微載體球轉球放大
陸麗芳,Christain Kaisermayer, 姚鈺舜,隋禮麗
通用電氣醫(yī)療集團生命科學部,Fast Trak研發(fā)中心,上海
概要
Vero 細胞能被廣泛應用于疫苗的生產。Vero 細胞的培養(yǎng)技術能否成功放大對于該技術能否大規(guī)模應用于疫苗生產至關重要。作為貼壁細胞,我們的經驗證明Vero 細胞能夠成功地用微載體技術在 WAVE 反應器中生長。為了進一步尋求放大培養(yǎng)的可能性,我們在 WAVE 反應器中進行了細胞從微載體 Cytodex 1 上的球轉球實驗。一系列的實驗都相當成功。Vero細胞首先在 10 L的培養(yǎng)袋中用Cytodex 1微載體培養(yǎng)到一定密度,生長在微載體上的細胞隨后用胰蛋白酶消化,經消化后基本脫離微載體的細胞最終和舊的微載體根據一定的傳代密度轉移到新的微載體培養(yǎng)體系中并開始新一輪細胞培養(yǎng)。我們的結果顯示,幾次這樣的轉移傳代前后,細胞的生長速度基本一致。Vero 細胞的微載體培養(yǎng)技術在 WAVE 反應器中放大完全可能。進一步的實驗顯示,在現有的工作條件下,Vero細胞在 Cytodex 上的培養(yǎng)以及球轉球工藝可以達到 10 倍的放大倍率。這為基于細胞培養(yǎng)的疫苗大規(guī)模工業(yè)化生產新前景提供了可靠的支持。
前言
Vero細胞最初起源于非洲綠猴腎,已知對多種病毒如 SV40、 SV-5、 麻疹病毒、蟲媒病毒、呼吸道腸道病毒、風疹、猿腺病毒、脊髓灰質炎病毒、流感病毒、副流感病毒、牛痘病毒等等,都敏感。Vero 細胞因而被廣泛應用于針對相應疾病的疫苗開發(fā)[1]。最近針對流感疫苗的開發(fā)就使用到了 Vero 細胞[2]。知名的制藥企業(yè)百特公司(Baxter Healthcare)成功利用 Cytodex3 型微載體進行 Vero 細胞流感疫苗的生產,使用 3 級不同的發(fā)酵罐進行微載體球轉球擴增,最終至 6000L 反應器的培養(yǎng)規(guī)模。諾華公司也早已在其歐洲的細胞培養(yǎng)工廠中得到許可使用細胞疫苗生產技術。諾華公司最近與美國衛(wèi)生與公共服務部(HHS)達成協(xié)議,后者贊助前者 4.86 億美元在北卡羅來那建立哺乳動物細胞疫苗生產基地,計劃 2012 年投入使用[3]。細胞疫苗技術,具有快速和可靠的特征,作為全球發(fā)展的大趨勢,將有望逐步替代目前的雞胚疫苗技術。
作為貼壁細胞,Vero 細胞需要生長于一定的表面,在小規(guī)模狀態(tài)下可以用 T 型培養(yǎng)瓶或滾瓶來進行培養(yǎng)。國內微載體細胞培養(yǎng)水平和國外差距較大,多數仍使用轉瓶/細胞工廠直接接種到 30L 發(fā)酵罐中,采用多個 30L 發(fā)酵罐平行放大操作。轉瓶培養(yǎng)屬于勞動密集型操作,無法對 pH、溶氧等參數進行精密控制,同時具有較高的污染風險。多個小型發(fā)酵罐的平行放大無法避免每個反應器之間的差異,增加了生產過程的控制點,不利于產品質量的穩(wěn)定性和整個生產工藝的驗證,限制了產能。
因此需要開發(fā)大規(guī)模微載體細胞培養(yǎng)技術以滿足生物技術發(fā)展的需要,而微載體球轉球放大工藝就是其中的關鍵點之一[4,5],以便在更大的工業(yè)規(guī)模進行培養(yǎng)和生產。衡量這一技術是否成功, 一方面固然是轉移是否成功,同樣重要的另一方面則是轉移后細胞是否能有同樣的生長狀態(tài)。
方法
WAVETM 反應器中 Vero 細胞的培養(yǎng)
在10升的細胞培養(yǎng)袋中,Vero在微載體 Cytodex 1 (Cyt.1)上貼壁培養(yǎng),微載體濃度是 3-6g/L,懸浮培養(yǎng)體積 1.5-3L。在接種前一天,細胞培養(yǎng)袋預先被放置到WAVETM 反應器上,充滿 10% CO2,并加入 70-90%培養(yǎng)體積所需的培養(yǎng)液以及微載體,并在 37°C 搖動過夜以便使溫度和 pH 得到充分平衡。接種當天,用胰酶把細胞從細胞工廠中消化下來,重新懸浮于新鮮的培養(yǎng)基中并轉移到預先平衡的細胞培養(yǎng)袋中,細胞接種密度控制在每毫升 3-5x105個細胞。培養(yǎng)條件是,搖速 11 rpm,角度 4 度,溫度 37°C。pH 控制在 7.0-7.3 之間。根據葡萄糖的代謝情況適時通過用新鮮培養(yǎng)液替換培養(yǎng)袋內的培養(yǎng)液來補充營養(yǎng)。每天采樣監(jiān)測細胞生長速度和狀態(tài)。
細胞計數的方法是,用含檸檬酸的結晶紫染色液破碎細胞,釋放并染色細胞核,通過在顯微鏡下計數細胞核來確定細胞的數量。微載體上的細胞形態(tài)則通過固定,蘇木素染色和顯微鏡來觀察并照相。細胞密度達到約每毫升2-3x106個時,進行球轉球實驗。每次球轉球實驗后,細胞在WAVETM 反應器內用上述同樣的方法進行數天的培養(yǎng),觀察生長狀況。
在瓶子內進行球轉球實驗
在 WAVETM 反應器內細胞密度達到需要的水平時,Vero 細胞微載體培養(yǎng)懸浮液即被轉移到另外一個透明的瓶子中并移到生物安全柜中。后面的清洗和胰酶消化過程等均在生物安全柜內進行。在微載體沉降下來之后,去除上清。剩下的微載體被轉移到 500 毫升無菌透明的瓶子內(這是根據 2 升培養(yǎng)體積所需的瓶子大小,不同的情況應有不同的需求)。盡量多地去除上清。加入 400 毫升 37°C 預熱的含 0.02% EDTA 磷酸緩沖液 (PBS-EDTA), 適當混合,待微載體沉降后去除上清。以上同樣的過程重復 3次以使微載體得到充分洗滌。
長有細胞的微載體在用 PBS-EDTA 充分洗滌之后,即用含 0.02% EDTA 的 0.25%胰酶消化。2 升的培養(yǎng)體積(6 克微載體),胰酶用量為 300 毫升。胰酶預先在37°C 預熱,在與微載體混合之后置于 37°C 中并每隔 10 分鐘進行一次充分的混合。25-30 分鐘之后,根據所需要的接種密度和稀釋倍數,取一部分細胞-微載體-胰酶混合懸浮液到一個干凈的無菌轉移瓶內,與新鮮培養(yǎng)基混合并接種到一個新的培養(yǎng)袋中開始新一輪的培養(yǎng)。在 WAVETM 培養(yǎng)袋內進行球轉球實驗
在 WAVETM 反應器內細胞密度達到需要的水平時,球轉球實驗在 WAVETM 培養(yǎng)袋內進行。實驗開始前,準備裝有 5-10 升 PBS-EDTA 的液體轉移瓶和溶積 5-10 升的廢液瓶,滅菌。準備 1 升的液體轉移瓶兩個,滅菌,并在無菌條件下分別裝入胰酶和新鮮培養(yǎng)基。將 PBS-EDTA,胰酶和新鮮培養(yǎng)基分別預熱至 37°C。
在無菌條件下(如無菌管道焊接機)將這幾個瓶子與細胞培養(yǎng)袋接通。整個實驗過程中細胞培養(yǎng)袋均被置于反應器上。反應器停止搖動并停止加熱以防過熱或不均勻加熱。培養(yǎng)袋內長有 Vero 細胞的微載體會在數分鐘內沉到底部。用泵把盡量多的上清液移至廢液瓶。加入一定量的 PBS-EDTA,輕柔混勻后,再次沉降微載體并移去上清。如此重復三次,每次使用 PBS-EDTA 的量不超過一個培養(yǎng)體積。
長有細胞的微載體在用 PBS-EDTA 充分洗滌之后,與 37°C 預熱的含 0.02% EDTA 的 0.25%胰酶混合,在微載體密度為 3g/L 時,胰酶的用量為 15%培養(yǎng)體積。胰酶的用量可根據實際情況作調整。加入胰酶后的混合液每 10 分鐘輕柔搖動混合一次。25-30 分鐘后,細胞培養(yǎng)袋內的懸浮液被轉移至一個空的無菌轉移瓶內。用少量新鮮培養(yǎng)液淋洗培養(yǎng)袋一次并和前面的合并。根據所需要的接種密度和稀釋倍數,接種新的細胞培養(yǎng)袋并開始新一輪培養(yǎng)。
結果
在細胞培養(yǎng)袋中和外部瓶子中進行的球轉球實驗結果比較
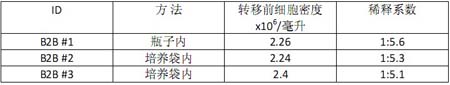
這里有三次球轉球實驗(B2B #1, #2, #3)。其中一次球轉球實驗(B2B #1)在培養(yǎng)袋外的瓶子中進行,另兩次(B2B #2 和#3)在 WAVETM 培養(yǎng)袋內進行。第一次(B2B #1)和第三次(B2B #3)實驗的 Vero 細胞來自通過細胞工廠接種到培養(yǎng)袋中并生長起來的細胞,而第二次實驗 (B2B #2)的 Vero 則直接來自第一次球轉球實驗后接種并培養(yǎng)起來的細胞。這幾次實驗我們均是在細胞密度超過 2x106時進行球轉球,并把
放大倍數控制在 5-6 倍。表 1 列舉的是這三次轉移的大致情形。在第一次轉移之前,細胞首先從細胞工廠接種到 10 升的培養(yǎng)袋內并培養(yǎng)生長到所需要的細胞密度。經過球轉球之后的細胞培養(yǎng)也是在 10升的培養(yǎng)袋內進行。
表1.各次球轉球實驗情況
每次球轉球前后的細胞生長情況都通過每天采樣來監(jiān)測。圖 1 和圖 2 顯示的就是根據每次培養(yǎng)每天細胞密度的增長情況繪制的細胞生長曲線。我們把相關聯(lián)的放在一起做比較。其中圖 1 顯示的是 B2B #1、B2B #2 之前和之后細胞生長曲線,而圖 2 則顯示的 B2B #3 之前及之后的細胞生長情況。我們可以看到在各次球轉球實驗前后,細胞都保持著良好的生長活力。在球轉球實驗之后,因起始細胞密度相比初始種子培養(yǎng)的稍低,因此需要多一天時間達到相似的細胞密度�?傮w來說,細胞生長的速度基本相同。
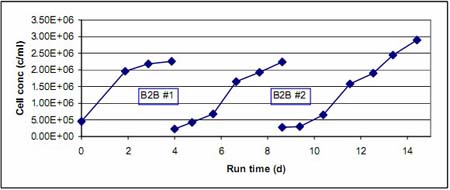
圖1.球轉球實驗B2B #1和 B2B #2前后細胞生長曲線
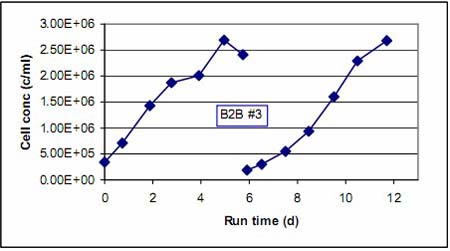
圖2.球轉球實驗B2B #3前后細胞生長曲線
圖 3 和圖 4 顯示的是球轉球前后 Vero 細胞在微載體上的生長情況,分別有接種前第一、第三和第五天細胞的形態(tài)。圖 4 的上面三張小圖顯示了球轉球實驗 B2B #3 之前來自細胞工廠種子培養(yǎng)的細胞生長形態(tài)。這是典型的 Vero 細胞種子培養(yǎng)的生長情況。通常 90%以上的 Vero細胞會在接種 4 小時之內貼到微載體上并在 24 小時內進入對數生長期。從圖 3 和圖 4 中各次球轉球實驗之后 Vero 細胞在微載體上的生長情況,可以看到球轉球實驗之后細胞保持有良好的和種子細胞培養(yǎng)相似的生長形態(tài)。
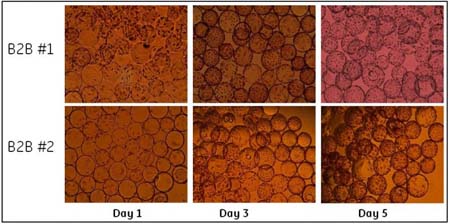
圖 3.球轉球實驗 B2B #1和B2B #2后 Vero細胞在微載體上的生長情況
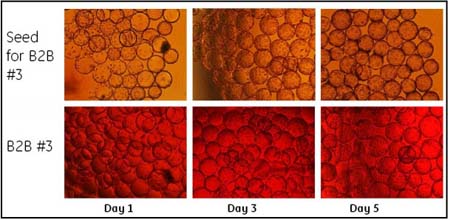
圖4.球轉球實驗B2B #3前后 Vero細胞在微載體上的生長情況
在細胞培養(yǎng)袋中進行的高倍率放大
我們通過兩種方式嘗試把球轉球放大工藝的放大倍率提升到十倍。第一種是用 6 g/L 的微載體密度培養(yǎng) Vero 細胞至 4x106/毫升左右的細胞密度。球轉球以后以十倍的放大倍數(培養(yǎng)體積放大,微載體表面積放大,或者兩者兼具)開始新一輪的培養(yǎng)。第二種是如上以 3g/L 的微載體密度培養(yǎng),待細胞密度接近 3x106
時,進行球轉球實驗,并采用培養(yǎng)體積和微載體表面積均為十倍的放大倍率。為彌補起始細胞密度過低可能會帶來的生長緩慢,我們嘗試在球轉球之后用較少的培養(yǎng)體積培養(yǎng)。待細胞數增長到一定程度時,再添補新的培養(yǎng)基到需要的體積。觀察球轉球前后的細胞生長情況。
B2B #4 采用第一種方式進行高倍率放大,即用 6g/L 的微載體密度培養(yǎng) Vero細胞至細胞密度 4.3x106/毫升,培養(yǎng)體積為 2 升。用胰酶把 Vero 細胞從微載體上消化下來。取十分之一的細胞/微載體懸浮液接種到新的 2 升的培養(yǎng)體積中,微載體濃度為 6g/L,這樣培養(yǎng)體積及微載體表面積的放大倍數均是十倍。作為平行比較試驗,取十分之一的細胞/微載體懸浮液接種到另一個 2 升的培養(yǎng)體積中,微載體濃度 3 g/L,如此培養(yǎng)體積放大十倍,微載體表面積放大五倍。兩個培養(yǎng)同時進行,觀察細胞生長的情況。
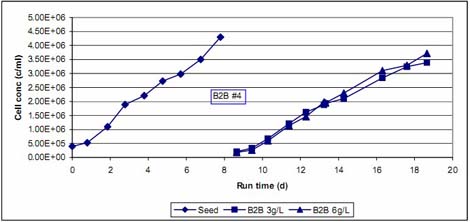
圖5.球轉球實驗B2B #4前后細胞生長曲線
圖 5顯示的是球轉球實驗B2B #4前后細胞生長曲線。有意思的是球轉球以后的兩個平行培養(yǎng)中細胞增長速度基本相似,雖然其微載體密度相差了一倍。它們比種子培養(yǎng)多用了 1-2 天達到相似的細胞密度。這應該是球轉球之后培養(yǎng)的起始細胞密度相對較低所致,但細胞倍增速度并不低。球轉球之后兩個培養(yǎng)前四天的細胞倍增速度均是 0.57 d-1,而種子培養(yǎng)前四天的細胞倍增速度是 0.54 d-1。
圖 6 顯示的是球轉球實驗 B2B #4 前后 Vero 細胞在微載體上的生長情況�?梢钥吹角蜣D球之后的培養(yǎng)雖然起始細胞數較少,但細胞貼壁和存活情況仍然不錯。在其后的幾天中細胞生長的形態(tài)也很穩(wěn)定和良好。雖然在最初幾天看似細胞在微載體上分布不均勻,但細胞增殖正常并在其后幾天迅速布滿所有的微載體。

圖6.球轉球實驗B2B #4前后 Vero細胞在微載體上的生長情況
B2B #5 采用第二種方式進行高倍率放大。用 3g/L 的微載體密度培養(yǎng) Vero 細胞至細胞密度 3.07x106/毫升,培養(yǎng)體積為 3 升。用胰酶把 Vero 細胞從微載體上消化下來。取十分之一的細胞/微載體懸浮液接種到新的 1.5 升的培養(yǎng)體積中,微載體濃度為 6g/L。待細胞密度達到 5x106/毫升以上時,補充新鮮培養(yǎng)基至培養(yǎng)體積 3升。這樣培養(yǎng)體積及微載體表面積的放大倍數均是十倍,最終微載體濃度為3g/L。而在培養(yǎng)初期,細胞密度和微載體密度均得到提高,從而提高了微載體和細胞的接觸機率,理論上有利于細胞貼附到微載體上并能更好地生長。作為平行比較試驗,取十分之一的細胞/微載體懸浮液接種到另一個細胞培養(yǎng)袋中,培養(yǎng)體積 3升,微載體濃度 3g/L。兩個培養(yǎng)同時進行,觀察細胞生長的情況。
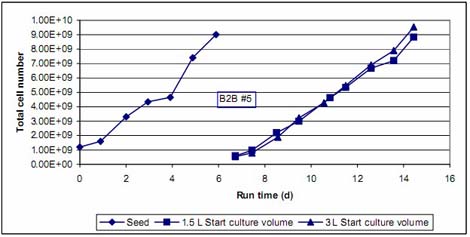
圖 7.球轉球實驗 B2B #5前后細胞生長曲線
圖 7 顯示的是上述球轉球實驗 B2B #5 前后的細胞生長曲線。由于其中一個在培養(yǎng)過程中有培養(yǎng)體積的變化,這里的縱坐標采用細胞總數。球轉球前后細胞生長速度基本一致。球轉球以后細胞仍然保持旺盛的生長活力。同樣有意思的是,球轉球后采用較小的培養(yǎng)體積培養(yǎng),從而使單位體積內細胞密度和微載體密度提高,細胞和微載體接觸機率提高,這樣的方法并沒有顯著地提高細胞的生長速率。這表明細胞在稍低的接種密度下也能很好的生長起來,并不需要用降低起始培養(yǎng)體積的方法來提高接種密度。
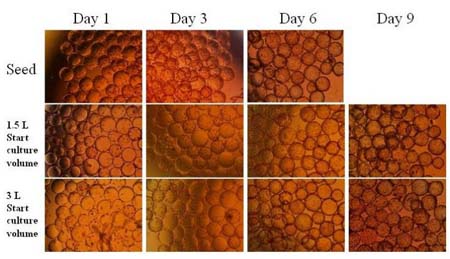
圖8.球轉球實驗B2B #5前后 Vero細胞在微載體上的生長情況
圖 8 顯示的是上述球轉球實驗 B2B #5 前后 Vero 細胞在微載體上的生長情況。因球轉球之后培養(yǎng)中細胞起始密度較低,培養(yǎng)時間延長了兩天。也因此,除了相應于種子培養(yǎng)的在第一、三、六天的細胞形態(tài)外,我們這里也列出了球轉球后培養(yǎng)了九天后細胞在微載體上的形態(tài)照片。球轉球后細胞貼附和生長情況良好。我們也看到分別用 1.5 L 和 3 L 的起始密度培養(yǎng)細胞最初的貼附情況,貼附數量,以及后面的細胞生長情況基本沒有差異。這也提示了提高單位體積內細胞密度和微載體密度,從而提高細胞和微載體接觸機率的方法并沒有帶來太大的好處。
討論
在這一部分的工作中,我們做了 Vero 細胞從微載體上的球轉球實驗,細胞培養(yǎng)在 WAVETM 反應器內進行,球轉球實驗在瓶子內或 WAVETM 培養(yǎng)袋內進行。實驗結果顯示球轉球實驗相當成功,Vero 細胞的微載體培養(yǎng)在 WAVETM 反應器內放大是可行的。
我們分別嘗試了在瓶子中(B2B #1)和在 WAVETM 培養(yǎng)袋中(B2B #2 和 B2B #3)進行球轉球實驗。在實驗室小規(guī)模情況下,在瓶子中進行球轉球實驗相比在細胞培養(yǎng)袋中進行有一定的優(yōu)勢。前者操作起來比較容易。在一個透明的瓶子中,沉降后的微載體更容易被清晰地看到,所以能更多地去除上清。這樣微載體能得到更有效的清洗。另外瓶子也可以用水浴來保持恒溫,如果不太大的話可以較劇烈地搖動。這樣細胞能更有效地脫離微載體。然而,如果考慮到大規(guī)模的培養(yǎng),球轉球實驗需要在 WAVETM 培養(yǎng)袋內進行,因為這樣就有一個全封閉的系統(tǒng)來更好地操作較大的體積。從WAVETM 培養(yǎng)袋中進行球轉球實驗(B2B #2和B2B #3) 得到的結果來看,這種方法效果也很不錯,只是需要較多的 PBS來洗滌,胰酶的用量也稍多。
胰酶消化較長時間能夠更好地使細胞和微載體完全分離。但消化太長時間也會降低細胞活力并影響細胞重新貼壁的效果。因此胰酶消化的時間最好能控制在40 分鐘之內。消化過程中,除消化時間外,酶用量、反應溫度、微載體和酶之間充分的混合是保證不同微載體上細胞同步消化的重要因素,從而有效避免酶的局部過量和潛在的細胞損傷。
相比攪拌罐而言,WAVE 反應器在同一個培養(yǎng)袋中可以有更寬的培養(yǎng)范圍(10-100%工作體積),對于種子擴增和細胞消化的不同反應體積,都可以提供均勻有效的混合,從而實現微載體的原位消化,而無需特定的消化反應器。避免了消化前后微載體的轉移,操作簡單,均勻有效的混合有利于精密控制消化反應的條件,最大程度保證細胞的完整性和回收,成為微載體球轉球成功放大的關鍵。
球轉球實驗 B2B #4 和#5 的結果提示,球轉球進行高倍率放大也完全可行,放大倍率可以達到十倍,前提應該是讓種子培養(yǎng)達到足夠的細胞密度以保證能有足夠多的細胞進入下一步培養(yǎng)。足夠的細胞接種密度,以及細胞數和微載體表面積的比例兩者共同保證了細胞的有效貼壁并快速進入生長期。而我們的實驗表明,球轉球后微載體表面積或者是培養(yǎng)體積的在小范圍內的變化均不會對細胞的貼壁和生長產生太大的影響。
我們在這里所描述的幾次球轉球實驗均是把一部分舊的微載體同細胞一起轉移來完成的。從各次球轉球實驗前后細胞在微載體上生長的形態(tài)來看,細胞能在微載體上均勻地分布。因此,舊的微載體同細胞一起轉移并不影響細胞貼壁到新的微載體上。如果不和舊的微載體一起轉移的話,就需要把細胞和微載體分離。這就意
味著需要額外的步驟和較長的工藝時間。這些額外的步驟還需要更多復雜的設備因而也增大了污染的風險。由于細胞沒有在微載體上不均勻的分布或更集中于舊微載體的情況,我們認為沒有必要把細胞和舊的微載體分開。
結論
通過在瓶子里或直接在細胞培養(yǎng)袋中進行的細胞和微載體分離的方法,WAVETM 反應器中的球轉球實驗能夠成功地進行。且放大倍率可以很容易地達到十倍。轉移之后 Vero 細胞能保持和種子細胞相似的生長特征。生長在微載體上的Vero 細胞用 37℃預熱的 PBS-EDTA 洗滌,用 37℃預熱的胰酶進行處理,胰酶處理的時間不超過40分鐘。轉移過程中沒有必要把細胞和舊的微載體分開。
WAVE 微載體球轉球技術為微載體細胞培養(yǎng)的規(guī)模放大提供了可靠支持,該技術可以在同一個培養(yǎng)袋中實現原位消化,然后直接轉移到更大規(guī)模的 WAVE 反應器中重新貼壁擴增而無須使用單獨的消化反應器,消化條件容易控制,設備投資成本低;無菌焊接機和封口機配合細胞培養(yǎng)袋可以方便的實現無菌管道化封閉生產,不僅操作簡單避免污染,同時防止操作人員對病毒的暴露,實現更加安全的生產操作。因此,WAVE 生物反應器進行規(guī)�;⑤d體細胞培養(yǎng)可以取代繁冗的轉瓶和多個小規(guī)模反應器的培養(yǎng)工藝,成為疫苗規(guī)�;笊a的發(fā)展趨勢。
參考文章
[1]. History and Characterization of the Vero Cell Line -- A Report prepared by CDR Rebecca Sheets, Ph.D., USPHS CBER/OVRR/DVRPA/VVB for the Vaccines and Related Biological Products Advisory Committee Meeting to be held on May 12, 2000 OPEN SESSION www.fda.gov pdf
[2]. Cell culture (Vero) derived whole virus (H5N1) vaccine based on wild-type virus strain induces cross-protective immune responses. Kistner O, Howard MK, Spruth M, Wodal W, Bruohl P, Gerencer M, Crowe BA, Savidis-Dacho H, Livey I, Reiter M and others. 2007, Vaccine 25(32):6028-6036.
[3]. Flu Vaccine Race Against The Clock. Thayer AM. 2009, Chemical & Engineering News, September 28, 2009, 87(39), p27-33
[4]. A novel mammalian cell (Vero) derived influenza virus vaccine: Development, characterization and industrial scale production. Kistner O, Barrett PN, Mundt W, Reiter M, Schober-Bendixen S, Eder G, Dorner F. 1999. Wiener Klinische Wochenschrift 111(5):207-214.
[5]. High immunogenic enterovirus 71 strain and its production using serum-free microcarrier Vero cell culture. Liu CC, Lian WC, Butler M, Wu SC. 2007. Vaccine 25(1):19-24.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:[email protected]